Durante la sesión de esta semana, y aprovechando la ocasión para despabilarnos del letargo dejado por el receso de primavera, dejamos de lado las simulaciones basadas en sistemas macroscópicos para introducirnos a sus características microscópicas.
En anteriores entregas hemos discutido las bases de la física clásica, formada principalmente por las leyes de Newton que describen el movimiento de una partícula. Sin embargo, la necesidad de estudiar los procesos que ocurren con la materia al tratarla como un conjunto dio origen a lo que hoy conocemos como termodinámica, compartiendo intereses tanto de la física como de la química.
La termodinámica es uno de los temas más extensos, interesantes y utilizados al hablar de un proceso. Por lo menos para un servidor, es una de las áreas de la ingeniería que más me agradan y que al mismo tiempo me genera más interés. Esta ciencia describe en su primera ley, para un sistema macroscópico, la ley de la conservación de la energía, en la denominada ley cero establece relaciones de equilibrio entre diferentes cuerpos y la tercera ley, quizás la más atractiva de todas, introduce el concepto del orden de un sistema: la entropía.
La importancia de la termodinámica radica en la forma en que describe un proceso. Por ejemplo, si yo le menciono que cuando enciende la estufa, la reacción que toma lugar es la siguiente (ya que el gas natural está compuesto principalmente de metano, CH4):
la primera ley es útil para calcular la cantidad de energía que libera la reacción. Esto es del todo cierto, cuando sucede esta reacción, el hecho de tener fuego indica que existe una liberación de energía en sus formas luminosa y como calor.
Hasta este punto todo va bien, no? La reacción libera energía, y parte de esa energía que libera la utilizamos para cocer nuestra milanesa empanizada (provecho). Pero qué sucede si ahora cambio mi versión y le digo que la reacción que toma lugar durante el encendido de su estufa es la contraria?

Podemos aplicar de nuevo la primera ley para calcular la cantidad de energía que la reacción absorbe para poder llevarse a cabo, pero… nosotros sabemos que la reacción libera fuego, en vez de consumir energía, porque es lo que nuestra experiencia nos dicta. Piense un momento el lector a donde queremos llegar con este ejemplo.
Ahora sí, prosigamos. Por qué la reacción se da de la primera forma, liberando energía, y no de la segunda, absorbiendo energía? Precisamente para resolver esta duda llega a auxiliarnos la tercera ley, aplicando el término de entropía.
La entropía es, como se mencionó líneas arriba, una medida del orden que posee un sistema. Si yo tengo una bolsa con 10 canicas rojas y otra con 10 canicas azules, llamémosle a este estado el estado 1, y mezclo ambas bolsas, siendo éste el estado 2, cuál cree el lector que tiene un mayor orden? Por supuesto el estado 1, en donde todas las canicas rojas están juntas y todas las azules lo están también, a diferencia del estado 2 en donde se tienen todas las canicas revueltas. Si la entropía es una medida del orden de este sistema, el estado 1 debe tener una entropía menor que el estado 2. Dicho en palabras simples, al aumentar el desorden, lo hace también la entropía.
Veamos ahora un ejemplo más claro antes de regresar con el proceso de nuestra estufa: los átomos y moléculas de la materia, por el simple hecho de tener una temperatura por encima del cero absoluto, se encuentran en constante movimiento. En el estado sólido, por tener un volumen definido y una temperatura relativamente baja, los átomos y moléculas tienen un menor movimiento que en el estado líquido, que a su vez en el estado líquido existe un menor movimiento que en el estado gaseoso, en donde la temperatura excita las partículas internas y el aumento en el volumen ocasiona un movimiento mayor. Como consecuencia, el estado sólido tiene asociado una menor entropía que el líquido, que a su vez tiene asociado una menor entropía que el estado gaseoso.
Podemos deducir entonces que la entropía aumenta conforme lo hace la temperatura. Esto tiene sentido, la energía cinética de los átomos y moléculas aumenta con la temperatura, por lo que tienen una mayor cantidad de colisiones, incrementando el desorden y, por consecuente, la entropía. Volviendo entonces a nuestro ejemplo con la estufa, los gases de combustión tienen una mayor temperatura que los gases de reacción, por lo que tienen asociada una mayor entropía.
He aquí en donde se tiene una de las grandes aplicaciones de la entropía, la entropía del universo debe ir siempre en aumento, no importa qué tipo de proceso se tenga. Es decir, que el proceso ocurre en la dirección en la cual la entropía aumenta. Dado que los gases de combustión de la estufa tienen asociada una mayor entropía que los gases de reacción, para que la entropía resultante aumente la reacción debe realizarse de la primera forma. La entropía es útil entonces para determinar la “espontaneidad” de un proceso, o la dirección que éste lleva.
Ahora bien, existe también un principio que describe de manera similar este fenómeno de espontaneidad, conocido como el principio de la energía mínima, en donde se establece que para un sistema cerrado, en un ambiente y con una entropía constantes, la energía interna del sistema decrece aproximándose a un nivel de energía mínimo conforme se acerca al equilibrio. Este principio no es más que una reformulación de la tercera ley que, a diferencia de este principio y como mencionamos anteriormente, establece que para un sistema aislado la entropía se incrementa tendiendo hacia un máximo conforme se acerca al equilibrio. La diferencia estriba en que en el sistema aislado, por definición, la masa y energía del sistema no pueden intercambiarse, permaneciendo constantes, mientras que en un sistema cerrado existe intercambio de energía, por lo que únicamente la masa permanece constante. Aplicando la primera y segunda ley es notorio que la entropía debe aumentar o la energía interna debe disminuir, según sea el caso.
Retomando un poco nuestro camino, al aplicar la termodinámica clásica a un sistema, en realidad lo que estamos haciendo es considerar el conjunto de partículas como un cuerpo uniforme. Por ejemplo, un gas se considera como un conjunto de moléculas puntuales que se mueven interactuando muy poco, o en su defecto, se formula un modelo en donde las moléculas son consideradas como una enorme cantidad de esferas rígidas que chocan entre sí. El problema se tiene al momento de analizar el total de estas esferas, de acuerdo al número de Avogadro, un mol de cualquier sustancia contiene 6.022 x 10 ^ 23 moléculas, por lo que evaluar de esta forma una cantidad de materia mínima razonable consistiría en un esfuerzo computacional notable, especialmente en épocas de menor tecnología.
Esta problemática orilló a Gibbs y Einstein a formular la mecánica estadística, la cual no es más que la aplicación de la teoría de probabilidad al estudio del comportamiento termodinámico de un sistema formado por un gran número de partículas. La termodinámica es una ciencia experimental, por lo que pueden hacerse predicciones de un sistema en el cual no se conoce el mecanismo del proceso, y es esta precisamente una de las principales desventajas de la termodinámica, el tener un sistema del cual no se conoce su mecanismo.
De cualquier forma, la información relevante puede obtenerse si se conoce la conexión entre las propiedades macroscópicas y microscópicas, lo cual constituye la base de la mecánica estadística. La gran diferencia entre la termodinámica clásica y la mecánica estadística, es que en la primera la entropía únicamente puede calcularse de manera experimental mientras que en la segunda es una función de la distribución del sistema y sus micro-estados.
Hablar de mecánica estadística, y de los aspectos microscópicos del sistema, en donde estamos haciendo la mención de que un sistema se conforma por un conjunto de partícula que interactúan entre sí, nos lleva a pensar en modelos de simulación basados en agentes. Para comenzar, un agente no es más que la representación de una partícula única que tiene cierta autonomía, más que una inteligencia artificial. Una simulación basada en agentes, incorpora al conjunto de agentes, así como sus acciones e interacciones con el fin de determinar la forma en que se comporta el sistema de manera global.
Este tipo de modelos permiten simular entonces el comportamiento macroscópico de un sistema formado por un conjunto de partículas, incluyendo no solo la forma en que se comportan como un todo, sino la forma en que interactúan las partículas entre sí.
El software seleccionado para simular en esta ocasión es el Recursive Porous Agent Simulation Toolkit (Repast) por ser uno de los paquetes estándares utilizado para este propósito, además de ser de distribución libre. El ejemplo que más le llamó la atención a un servidor se trata de uno llamado Autocatalysis, en el cual se lleva a cabo la simulación de un reactor con especies auto-catalíticas.
Una reacción auto-catalítica se caracteriza por la generación de un producto que actúa como catalizador de la reacción misma, es decir, que el compuesto que se está produciendo interactúa con el reactivo como un acelerador para producir más de este compuesto. Por lo tanto, durante una reacción auto-catalítica la conversión del reactivo es lenta al inicio pero aumenta rápidamente con el tiempo debido conforme aumenta la concentración del producto. La figura 01 muestra el primer punto del compuesto catalizador cuando el tiempo es de 3.5 segundos.

Figura 01. Cantidad de producto en el inicio de la reacción, representado por agentes.
El tiempo continúa aumentando. La figura 02 muestra el avance de la reacción, pero la concentración de producto aún no es suficiente para comenzar a notar el efecto de auto-catálisis.

Figura 02. Conversión.
Cuando el tiempo llega a 63.5 segundos, el compuesto auto-catalítico producido hasta el momento comienza no es suficiente para notar el fenómeno de catálisis (figura 03), siendo baja la velocidad de desaparición del reactivo (figura 04), al igual que la velocidad de aparición del producto (figura 05).

Figura 03. Cantidad de producto a los 63.5 segundos, representado por agentes.

Figura 04. Cantidad de reactivo presente a los 63.5 segundos.

Figura 05. Cantidad de producto presente a los 63.5 segundos.
A un tiempo de 166.5 segundos, el compuesto ha acelerado considerablemente la reacción (figura 06) y tanto la desaparición del reactivo (figura 07) como la aparición del producto (figura 08) tienen pendientes más pronunciadas.

Figura 06. Conversión a los 166.5, representado por agentes.

Figura 07. Cantidad de reactivo presente a los 166.5 segundos.
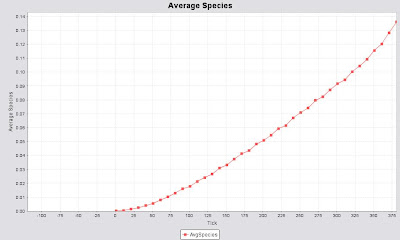
Figura 08. Cantidad de producto presente a los 166.5 segundos.
A un tiempo de 387.0 segundos, hemos pasado la velocidad máxima de reacción y el sistema comienza a tender hacia un equilibrio, esto es debido al efecto mismo de auto-catálisis. El producto no solo se está produciendo, sino que además tiene como trabajo reaccionar con el reactivo para producir a su vez más producto. Esto viene identificado en la figura 09, donde los colores obscuros representan el compuesto ya producido y los colores claros el mismo compuesto recién producido. Este fenómeno explica la velocidad tan baja en la desaparición del reactivo (figura 10) y el cambio de pendiente en la desaparición del producto (figura 11). Es evidente que la tasa de producción del compuesto producto es inferior a su tasa de consumo.

Figura 09. Conversión a los 387.0, representado por agentes.

Figura 10. Cantidad de reactivo presente a los 387.0 segundos.

Figura 11. Cantidad de producto presente a los 387.0 segundos.
Los parámetros utilizados para la simulación se encuentran en la figura 12.

Figura 12. Parámetros de la reacción.
Ahora bien, si dejamos que la reacción continúe, este “equilibrio” permanece oscilando (figuras 13 y 14). Es por esto, que las reacciones auto-catalíticas deben estudiarse a fondo para determinar el mejor momento para detener la reacción, antes que la cantidad máxima de producto comience a disminuir. La simulación basada en agentes puede aplicarse perfectamente a estos cálculos si se conoce el mecanismo de reacción, dado que cada molécula tanto de reactivo como de producto se comporta de manera muy diferente, basta con que el lector piense que una molécula de producto puede tomar caminos muy diferentes: puede formarse y quedarse sin interacción alguna, o interactuar solo físicamente con otras moléculas de producto, o puede formarse y reaccionar con otras moléculas de reactivo para producir otras moléculas de producto. Si a esto le añadimos el desorden que existe dentro del reactor y los movimientos aleatorios de cada molécula, el estado macroscópico carecerá de información suficiente para hacer una predicción acertada.

Figura 13. Cantidad de reactivo presente a los 843.0 segundos.

Figura 14. Cantidad de producto presente a los 843.0 segundos.
Hasta la próxima entrega.

No hay comentarios:
Publicar un comentario